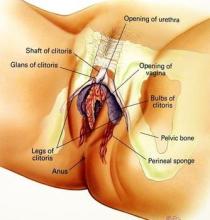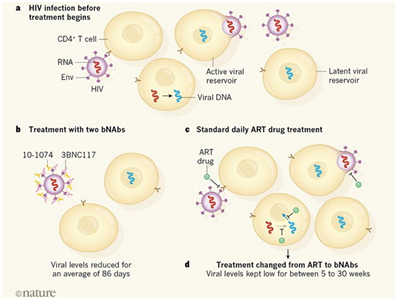
图6. 图a:HIV病毒入侵T细胞的过程;图b:两种广泛中和抗体联合使用抵抗HIV感染;图c:利用ART药物治疗HIV感染;图d:停用ART药物之后进行广泛中和抗体治疗。
2018年9月,Julia A. Sung等人在一项小型概念验证研究中,培养出体外增殖的HIV特异性T细胞(ex vivo expanded HIV-specific T cell, HXTC)。他们在2周内对6名已接受ART药物治疗后病毒载量下降不可检测到的水平的HIV感染者进行了两次HXTC输注。这6名HIV感染者对这种治疗耐受性良好,并且几乎没有不良事件产生[14]。此外,两名HIV患者在这两次HXTC输注后表现出可检测到的T细胞介导的抗病毒活性增加,不过这种轻度至中度影响的临床意义尚不清楚。
2018年8月,Robert A. Dick等人发现在HIV-1的未成熟发育和成熟发育阶段,肌醇六磷酸(IP6)在形成蛋白晶格结构的通路中起着关键作用[15]。当这种病毒在细胞内发育时,它有助于组装未成熟的晶格。这种未成熟的晶格在这种病毒出芽后会遭受降解,并从细胞膜上切割下来。在此期间,IP6还促进一种成熟的蛋白晶格在这种病毒颗粒内组装。这些研究结果为开发潜在的新疗法打开了大门。一种策略是人们开发或鉴定类似于IP6并结合到与IP6相同的位点上的药物,从而阻断这种小分子并阻止这种病毒成熟。
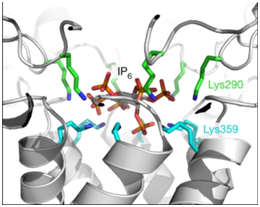
图7. 图片来自Nature, doi:10.1038/s41586-018-0396-4。
2018年8月,Brinda Emu等人发现在接受伊巴利珠单抗治疗一周后,在40名遭受多重耐药性HIV感染的患者中,绝大多数患者(占83%)血液中的HIV病毒载量下降了[16]。在25周后,将近一半患者的病毒载量下降到检测水平之下。他们还报道这些患者的CD4+ T细胞水平增加了。一名患者经历了一次不良事件,这种不良事件被认为与伊巴利珠单抗治疗相关,也因此导致这名患者退出这项研究。作为第一种被批准用于治疗HIV感染的单克隆抗体,伊巴利珠单抗靶向HIV入侵CD4+ T细胞所需的一种主要受体,因此对已尝试过其他几种药物治疗的HIV感染者来说,它是一种很有前景的选择。
2018年7月,鉴于HIV疫苗开发的一个关键障碍是临床试验和临床前研究之间缺乏直接的可比性,Dan H Barouch等人在平行的临床研究和临床前研究中评估了一种先进的基于腺病毒血清型26(adenovirus serotype 26, Ad26)的镶嵌HIV-1候选疫苗来确定最佳的HIV疫苗方案,以便推进到人体临床疗效试验[17]。在涉及393名健康成年人的1/2a期临床研究(被称作APPROACH)中,所测试的启动-增强疫苗方案都能够在健康的志愿者中产生抗HIV免疫反应,具有良好的耐受性,此外所产生的不良反应为轻度至中度的,没有出现4级不良事件或死亡病例。在涉及72只恒河猴的临床前研究中,这种相同的基于Ad26的镶嵌疫苗方案也为猴子提供最好的保护:在遭受六次SHIV攻击后,三分之二的的已接受疫苗接种的猴子完全免受SHIV感染。
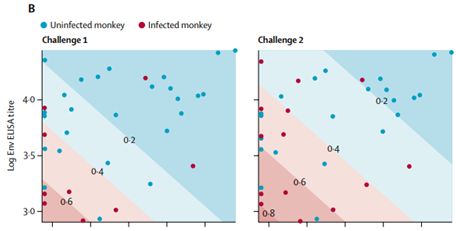
图8. 图片来自Lancet, doi:10.1016/S0140-6736(18)31364-3。
2018年6月,Jenna B. Honeycutt等人发现作为一种白细胞和免疫系统中的一种至关重要的组成部分,T细胞本身足以在大脑中建立和维持HIV感染[18]。这也是首次证实人巨噬细胞和T细胞都能够建立和维持大脑中的感染。这些结果表明大脑可能是患者体内的一种重要的HIV库。未来的研究将需要确定在ART治疗期间在大脑中持续存在的这种病毒是否能够在停止ART治疗后重新激活这种感染。
2018年6月,Kai Xu等人报道了一种基于HIV病毒的脆弱位点结构---即融合肽,它是HIV侵入人类细胞所使用的位于HIV-1表面刺突蛋白上的一小段保守的氨基酸,可以介导病毒包膜和宿主细胞膜融合,进而促进病毒侵入宿主细胞---的实验性疫苗诱导小鼠、豚鼠和猴子产生抗体,所产生的这些抗体结合到这种HIV融合肽上,在全球代表性的208种HIV毒株中,能够中和其中的31%毒株[19]。
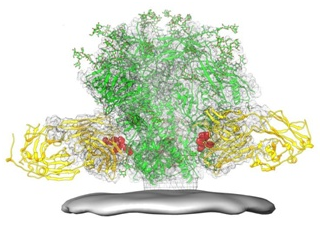
图9. HIV-1表面刺突蛋白上的融合肽表位(红色),图片来自NIAID。
2018年5月,Lijuan Yin等人利用CRISPR/Cas9基因组编辑技术靶向病毒长末端重复序列和基因编码序列,从而成功抑制HIV-1的多个感染步骤,包括HIV-1复制、逆转录和整合[20]。他们观察到Cas9/gRNA对HIV-1感染的强烈抑制作用,这不仅是因为Cas9切割而导致病毒DNA的插入和缺失,还源于晚期病毒DNA和整合病毒DNA的显著降低。这一步的实验表明当Cas9完全位于细胞质中时,它与位于细胞核的Cas9一样强烈地抑制HIV-1。
2018年5月,Leor S. Weinberger团队通过将数学建模、成像和遗传学方法相组合,证实这种类型的选择性剪接发生在转录后,这是挑战常规的,这是因为科学家们在此之前都认为剪接与转录同时发生。这项研究证实HIV有目的地保留这种非常低效的转录后剪接过程,而且通过校正它,科学家们可能显著地破坏这种病毒[21]。这些发现可能有助于人们开发出新的HIV治愈策略。