2018年12月23日/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,美国马里兰大学医学院的Robert Gallo团队[1][2]和法国巴斯德研究所的Luc Montagnier团队[3]都从艾滋病患者血液或组织中分离出一种新的逆转录病毒,并证实这种病毒是导致艾滋病的罪魁祸首。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。1986年,科学家们正式将这一病毒命名为“人类免疫缺陷病毒”,即HIV。随后,科学家发现HIV的主要传播途径有血液传播、性传播和母婴传播。
图1. 图片来自CDC/C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus. CC BY 0。
HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。目前,HIV/AIDS治疗方法主要包括终生的抗逆转录病毒药物(ART)治疗。尽管每天服用ART药物让血液中的HIV保持在较低的水平,但是当前还没有办法将持续存在的受到HIV潜伏感染的细胞(即HIV病毒库)从体内完全清除。如果HIV感染者停止服用抗逆转录病毒药物,那么这些潜伏的HIV就会迅速反弹。此外,尽管服用ART药物已被证实能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
在持续35年的全球HIV/AIDS流行病中,仅有四种HIV疫苗概念在人体中进行了测试,并且仅有一种HIV疫苗概念在人体临床疗效试验中表现出提供保护的证据---一种金丝雀痘病毒载体启动疫苗-gp120增强疫苗方案,它在泰国开展的RV144临床试验测试中将人体的HIV感染率降低31%,但是这种疗效被认为太低而无法将它推广到常规使用。

图2. Timothy Ray Brown,图片来自Peter Rigaud。
迄今为止,全世界只报道了仅有的一名“柏林病人”Timothy Ray Brown被认为完全治愈了HIV[4]。2007年,Brown在德国一家医院接受通过CCR5△32/CCR5△32基因型造血干细胞移植治疗白血病后,他体内的HIV病毒也完全消失了,成为世界上首例被“治愈”的艾滋病患者。
据联合国艾滋病规划署(UNAIDS)估计[5],在2017年,全球有3690万[3110万~4390万]人感染上HIV;2170万[1910万-2260万]人正在接受治疗;180万[140万-240万]人新感染上HIV;94万 [67万-130万]人死于与艾滋病有关的疾病。
在2018年,科学家们在HIV的风险因素、致病机制、检测和治疗等方面取得重大的进展,让我们一起看看这个领域在这一年里取得的重大发现。
2018年12月,Benni Vargas等人利用含有潜伏性HIV-1的人细胞系,鉴定出12种激酶抑制剂阻断潜伏性HIV-1重新激活[6]。在这12种激酶抑制中,达鲁舍替(一种极光激酶抑制剂)和PF-3758309(一种PAK4抑制剂)是最为强效的,而且具有最小的毒性。
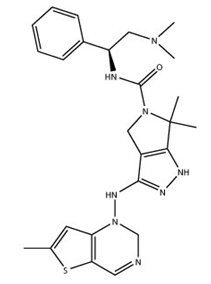
图3. 化合物PF-3758309的化学结构式。
2018年11月,Joakim Esbjörnsson团队在1990年至2013年这23多年时间里对4900名患者进行了随访,内容涉及包括血液测试在内的年度检查[7]。他们还比较了这群患者中的HIV-1阳性个体和HIV-1阴性个体。这些数据表明HIV-2患者遭受HIV相关感染和患上艾滋病的方式与HIV-1患者几乎是相同的,不过有一点需要提及的是,HIV-2患者的疾病进展相对要缓慢一些。这就表明HIV-2的致病性要比之前认为的更高。这一新发现表明早期治疗应当适用于所有HIV感染者,而不仅仅是那些HIV-1感染者。
2018年11月,Linling He等人开发出一种“未分割预融合优化(uncleaved prefusion-optimized approach, UFO)”方法而能够将HIV的Env三聚体结构稳定成为一种闭合的形状,通过将稳定的Env三聚体(每次最多能达到60个)与单个纳米颗粒相连接,连接后的单个纳米颗粒能模仿整个HIV病毒的球体结构。所开发的这种候选疫苗能诱发小鼠和兔子机体出现强大得抗HIV抗体反应,目前基于该策略的候选疫苗正在猴子体内进行测试[8]。
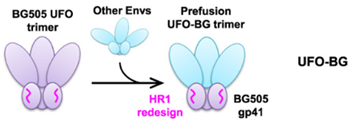
图4. 图片来自Science Advances, doi:10.1126/sciadv.aau6769.
2018年10月,Saurabh Mehandru等人在一项涉及6名患有轻度炎症性肠病(IBD)且伴随HIV-1感染的人接受抗α4β7药物---特别是维多珠单抗(vedolizumab, VDZ)---治疗的临床实验中发现,VDZ导致胃肠道中的称为淋巴细胞会集(lymphoid aggregates)的免疫细胞群体减少,其中淋巴细胞会集是维持HIV病毒库的重要避难所[9]。VDZ表现出强大的疗效和出色的安全性,具有良好的耐受性,仅报道了轻微的不良事件。这表明抗α4β7药物与广泛中和抗HIV抗体等其他药物联合使用有望治疗HIV-1感染。
2018年10月,Dan H. Barouch团队组合使用旨在靶向HIV的广泛中和抗体(bNAb)和刺激先天免疫系统的Toll样受体7(TLR7)激动剂能够延缓HIV在停止服用ART药物的猴子体内反弹。这些发现提示着这种双管齐下的方法代表着一种潜在的靶向这种病毒库的策略[10]。
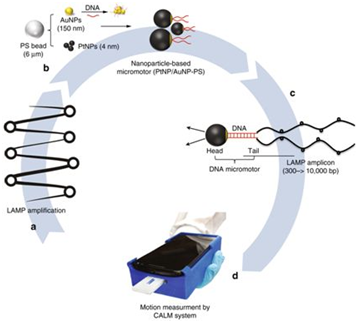
图5. 图片来自Nature Communications, doi:10.1038/s41467-018-06727-8。
2018年10月,Mohamed Shehata Draz等人利用纳米技术、微芯片(microchip)、手机和三维打印的手机附件,开发出一种便携式的可负担得起的移动诊断设备用于测试和监测HIV-1[11]。利用这种诊断平台,他们能够检测一滴血中存在的HIV-1 RNA。这种设备通过在手机上监测经过DNA修饰的聚苯乙烯珠的运动就可检测经过LAMP(loop-mediated isothermal amplification, 环介导等温扩增,一种不同于PCR的核酸扩增反应)扩增的HIV-1 RNA核酸。他们发现在一小时内,在临床相关阈值为每毫升1000个病毒颗粒时,这种设备检测HIV-1的特异性为99.1%,灵敏度为94.6%。值得注意的是,每次测试时,这种微芯片、手机附件和所使用的试剂的总材料成本低于5美元。
2018年9月,Michel Nussenzweig团队选择了两种抗体:3BNC117和10-1074,这两种抗体的功效都比之前测试的一种抗体更强,并且能够“中和”更广泛的HIV变异体。在一项临床试验[12]中,11名通过服用ART药物成功抑制了体内HIV感染随后停止服用这种药物的患者接受三次这两种抗体输注。在这11名停止服用ART药物的人中,有9人在平均15周内将这种病毒抑制到标准测试中的检测水平以下,在此之后,HIV水平发生了反弹。分析结果表明最HIV病毒水平最早发生反弹的两个人在这项临床试验开始时具有抵抗这两种抗体的HIV变体。令人关注的是,有两名参与者在停止服用ART药物一年后,仍然没有发生HIV病毒水平反弹。与此同时,Nussenzweig团队在另一项临床试验[13]中,7名未接受ART药物治疗因而在临床试验开始时具有相对较高的HIV病毒水平的患者接受三次这两种抗体输注。这两种抗体在临床试验开始时具有高水平HIV病毒的人体中表现不佳,但是在这7名参与者中,有4人在大约3个月的时间内确实成功地抑制了HIV。那些从一开始就对这些抗体输注没有作出反应的人携带着逃避这两种抗体的HIV病毒。