2018年获得国家药监局批准的很多药物,在相同的适应证下被美国FDA界定为孤儿药,包括治疗ALK阳性的非小细胞肺癌用药阿来替尼与塞瑞替尼,治疗黑色素瘤用药帕博利珠单抗,治疗非霍奇金淋巴瘤用药普乐沙福,白血病化疗药苯达莫司汀,治疗多发性硬化症药物特立氟胺,血友病药物科跃奇(重组凝血因子Ⅷ)与艾美赛珠单抗,治疗高尿酸症的药物拉布立海,治疗肺动脉高压症的药物司来帕格,阵发性睡眠性血红蛋白尿症(PNH)与非典型溶血性尿毒症综合征(aHUS)药物依库珠单抗等,这些药物的上市将大大提高我国罕见病治疗水平。
国产新药
2018年,国家药监局批准了9个自主创新药,包括恒瑞的吡咯替尼与硫培非格司亭,正大天晴的安罗替尼,和记黄埔的呋喹替尼,君实生物的特瑞普利单抗,信达生物的信迪利单抗,歌礼药业的达诺瑞韦,前沿生物的艾博韦泰,以及杰华生物的重组细胞基因因子衍生蛋白等。
这些产品的上市,一方面说明我国鼓励和引导创新政策取得了巨大成效;另一方面也表明,我国创新能力和水平还亟待提高,因为这些产品仍然以“Me-Too”类创新药为主,而且重复布局较为严重。数据显示,目前我国处在开发阶段的PD-1抗体多达40个。
除了9个自主创新药,国家药监局首次批准的国产新药还有罗沙司他,这是一个“First-in-class”药物。
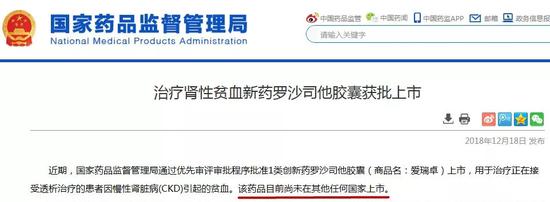
截至目前,该产品的全球多中心临床试验结果均已经达到治疗终点,有望在2019年获得FDA和EMA批准上市。笔者认为,国家药监局在FDA和EMA之前批准“First-in-class”创新药上市是史无前例的,一旦迈出这历史性的一步,以后将会成为一种常态。
创新药占据了全球70%以上的药品市场,是制药行业的主要利润来源。笔者认为,随着药品带量采购的推进,未来几年里,仿制药将不再是我国医药市场的主要增长点,企业想做大做强,必须要积极创新。
根据欧盟制药工业协会报告的数据,2011~2016年上市的新药,64.7%的销售额来自美国。因此,中国制药企业不但要积极创新,还要积极走出去。尽管进入21世纪以后,FDA对“Me-Too”类药物的审评尺度有所收紧,但部分高质量的国产“Me-Too”类创新药,也有望突破国界,从“中国新”走向“世界新”。
2018年48个全新药物获批上市,很多适应证药物的可及性将得到极大提高。但可及性的提高只是实现从“无药可用”到“有药可用”的形势转变,要真正惠及广大患者,还需要实现从“有药可用”到“有药且用得起”的转变。