原标题:坐拥7000多家药企,生产166138种药,中国为什么还会缺创新药?
9月19日,国务院办公厅发布《关于完善国家基本药物制度的意见》,要求坚持调入和调出并重,优先调入有效性和安全性证据明确、成本效益比显著的药品品种;重点调出已退市的,发生严重不良反应较多、经评估不宜再作为基本药物的,以及有风险效益比或成本效益比更优的品种替代的药品。
此前8月30日的国务院常务会议,指出《国家基本药物目录》新调入有效性和安全性明确、成本效益比显著的187种中西药,其中肿瘤用药12种、临床急需儿童药品22种,均比原目录显著增加。调整后基本药物目录总品种扩充到685种。
这反映了如今我国患者层面的需求已然发生变化,原有药物已经无法满足临床中的需要,亟待调整。
药品是特殊商品,和食品一样,药品的短缺同样也会引起严重的社会问题。今年夏天,《我不是药神》这部医药相关的电影爆火,曾引起“药品短缺、看病贵、吃药难”等话题的广泛热议。
那么,我国药品为何严重跟不上老百姓需要?未来的解决之路又在哪里?
文 | 张俊祥 李靖 丁红霞 汤黎娜 瞭望智库特约宏观观察员
1
人们为什么期待“药神”?
据统计,我国有7000多家规模以上制药企业,拥有16万个药品批号,按理说,本不应出现药品短缺现象。
但现实的状况是不仅药品种类少,天价药多,部分临床药品还出现了供应不足甚至断供的现象。因一些临床常用药和必备药品短缺而耽误患者抢救、治疗的事件时有发生。
我国临床药品短缺的现象具有较大的普遍性,甚至有些临床必需药品都会出现供应不足,如白血病药巯嘌呤断货、鱼精蛋白面临季节性“药荒”、阿托品和多巴胺断供、丝裂霉素和地高辛口服溶液缺货等,均已引起了社会的广泛关注,尤其是最近乳腺癌治疗药物——赫赛汀的短缺,甚至还引起了恐慌。
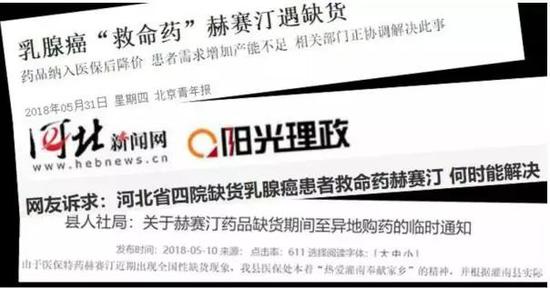
与其他由于药品价格低、企业不愿生产导致的短缺不同,赫赛汀其实根本不愁销路。
作为治疗乳腺癌的特效药物,也是目前治疗乳腺癌最好的药物,赫赛汀于1998年9月在美国正式上市;四年后,即2002年9月,赫赛汀进入了中国市场。上市后的赫赛汀,立即横扫全球抗肿瘤药市场,2012年的销售额就突破了60亿美元,并保持稳定增长多年,是全球最热销的药品之一。
那么我国赫赛汀缺货究竟是怎么造成的呢?
2018年以前,赫赛汀在我国的复合增长率超过15%,进入医保之前,赫赛汀的每单位市场价格约24500人民币,一个疗程需要约四五十万元,远超出普通患者的承受能力;2017年赫赛汀进入医保药品目录后,每单位市场价格降至7600元,大量患者开始使用,从而导致全国范围内供不应求。
赫赛汀的断供,折射出的是中国创新药能力的不足,无法在扩大的需求面前提供有效供给。
也正因如此,可以想见,赫赛汀的短缺仅仅是一个开始。随着国家药品开放的力度加大,当前主要依托进口的抗癌药物、心脑血管特效药等,将来一旦进入国家医保的目录,可承受治疗费用的患者数量势必增多,类似赫赛汀“药荒”这样的窘境恐怕将再次出现。

目前,我国对药品短缺已经投入关注,国家已经宣布梳理出了约130种临床易短缺药品清单,也发布了《关于改革完善短缺药品供应保障机制的实施意见》,为我国仿制药的研究提供了方向。但是我国创新药的研发水平仍然非常落后。
据统计,国民用上创新药的时间平均晚于美国6-7年,这个时间是进口药物进入国内的平均用时,而我国自主研发的药物时间会更长。例如上文提到的赫赛汀,今年8月——距离赫赛汀初在美国上市已有10年——三生国健药业研发的赫赛汀仿制药赛普汀终于被国家受理了上市申请,但最快上市还需6-18个月。由此可见国内药物研发方面与先进国家的巨大差距。
而新特药短缺还不仅是一个行业、一个领域的问题,更是国家需在更高的层面认识和解决的难题。我国每年新增400万癌症病人,如果上游供应链条出现问题,抗癌新药(特效药)的进口受限,将会对社会安全稳定造成严重的影响。
《我不是药神》原型陆勇(抗癌药代购第一人)的获释事件,引发了民众广泛关注,也得到了很多人的同情,这就反映了大众的关切,也关系到国家安全。

2
超过16万种药品,却远不能满足健康的需要
1949年至今,新中国的药物市场已经走过了69个年头,药物的产量、数量都得到了巨大提高。截至2018年7月,国产药品数量已达到166138种,进口药品共计4178种,药品种类短缺问题基本得到了解决。
以“神药”阿司匹林为例,我国目前生产阿司匹林的厂家共计665家;生产青霉素的厂家也达到了290家。2017年我国医药企业主营业务收入达到29826亿元,是1978年(72.8亿元)的409.7倍,69年来年均增长16.7%。
注:由于统计路径不同,1978年统计的是医药工业总产值,2017年统计的是规模以上工业企业主营业务收入。为了便于比较,统一称之为主营业务收入。
创新药物也实现了从无到有的突破,并快速增长。数据显示,截至2018年6月,我国批准上市的1.1类化药已有18个,生物药(1类+2类)已批准上市12个,处于研发状态的1.1类新药(化学药+生物药)已达到891个。
注:1.1类化药,指的是未在国内外上市销售且通过合成或半合成的方法制得的原料药或制剂。生物药(治疗用生物制品)1类,指未在国内外上市销售的生物制品;2类指单克隆抗体。
但是,与发达国家相比,我国药物真正的“质量”问题,即创新药物的数量依然没有得到有效提升。2008年是我国新药创制专项的肇始之年,以2008年为节点观察近年来我国药物创制的成果情况,数据显示(数据来自药渡经纬药物大数据库):



