2018年5月17-18日,WHO国际药物监测合作机构乌普萨拉监测中心(UMC)在瑞典乌普萨拉市举行40周年庆典,来自全球多国不良反应监测机构应邀大会报告。微芯生物总裁兼首席科学官作为大会邀请的两位工业界代表(分别为美国JNJ和中国微芯生物)之一,出席庆典会议并做了主题为“A Model for Future Pharmacovigilance Development in China”的报告。
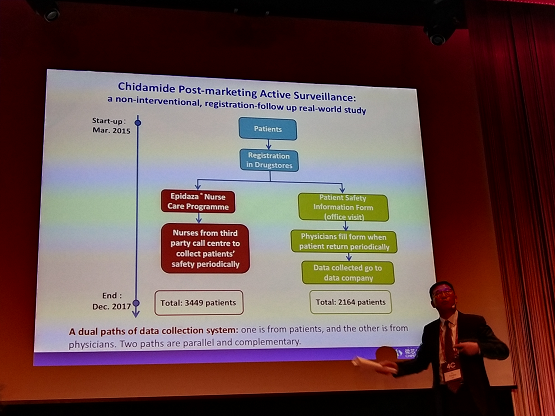
西达本胺片(爱谱沙®)为微芯生物自主研发的具有全球专利保护的原创抗肿瘤新药,属于化药1.1类。2014年12月,CFDA按照有条件批准程序批准西达本胺注册上市用于治疗复发或难治性外周T细胞淋巴瘤(PTCL)患者。
西达本胺片在批准上市之初,国家食品药品监督管理总局药品审评中心(CDE)与微芯生物相互沟通、共同努力,充分结合中国实情和国际常规,制定了一套双信息收集系统的主动监测计划。CDE和微芯生物共同制定的双渠道上市后主动监测计划实施非常成功,截止到2017年底,西达本胺片主动监测计划已对近3500例患者进行了安全性监测,实现了在真实世界、覆盖面积超大、大患者人群中完整收集不良反应,具有足够灵敏度发现新信号以起到对患者安全保护最大化,风险最小化的初衷,受到UMC监测中心及与会者的高度评价。