随着SMANCS治疗肝癌的成绩的陆续发表,1993年日本政府批准SMANCS全面进入临床治疗应用。日本各地乃至来自美国的患者都争相到熊本接受SMANCS治疗,前田博士因此还收到美国奥斯丁市颁发的荣誉市民和美国奥克拉玛州颁发的荣誉居民称号。大约1999年,我跟今野博士到临床观摩SMANCS治疗的期间,今野博士告诉我说,他认为肝癌如果不是特别的晚期,比如出现全身转移黄疸腹水等症状,在他看来,肝癌已经是可治愈的疾病。
发现大分子物质在肿瘤血管高渗透及潴留的EPR效应
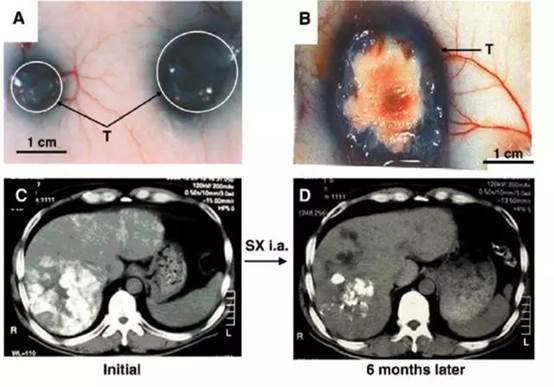
伊文斯蓝在肿瘤组织的 EPR 效应及 SMANCS 利用 EPR 效应在肝癌组织中的靶向治疗效果
在研发SMANCS的同时,前田注意到NCS及SMANCS的淋巴系统趋向性。肿瘤也是通过淋巴系统进行扩散的。大分子物质、脂质体也是通过淋巴系统回流到血液。伊文斯蓝Evans Blue是一种蓝色的染料,用来发现血管渗透性增高的现象。前田教授在研究细菌蛋白酶的病理学机制时常用这个染料。他们发现这个染料也可以让肿瘤组织出现特异性的染色现象。
1980年代末,松村保宏(Yasuhiro Matsumura)来到前田的实验室读博士。松村是一名外科医生,现任日本国立癌症中心东医院药物发展部部长。松村一开始研究癌症腹水中出现的缓激肽(Bradykinin)的现象。缓激肽是一种强烈的刺激痛觉同时刺激血管渗透性的生理因子。为了研究缓激肽在肿瘤血管渗透性方面的生理作用,他们对肿瘤组织的血管高通透性感到兴趣并开展进一步的研究。他们用铬51来标记了不同分子量的大分子:IgG(160kDa)、transferrin(90kDa)、albumin(67 kDa)、ovalbumin(47 kDa)和ovomucoid(28.8 kDa)、NCS(12 kDa),然后把这些放射物标记的蛋白注射到携带肿瘤的小鼠静脉中去。他们发现,40 kDa大小以上的大分子,随着时间的推移,在肿瘤组织里出现了潴留的现象,而在其他任何正常组织当中,这些大分子都没有出现漏出到血管外的现象。这阐明了肿瘤血管对大分子物质有独特的渗透性增加的现象(enhanced permeability)。更重要的是,这些漏出来的大分子,出现了潴留的现象(retention effect)。这个潴留现象,就是一种我们需要的药物被动性肿瘤靶向药物递呈作用。也就是说,要让抗肿瘤药物选择性地到达肿瘤组织发挥抗癌功效,抗癌药物应该在40kDa大小以上,或者能够主动与血液中的白蛋白结合,以药物-白蛋白结合体的形式在血液中运动。
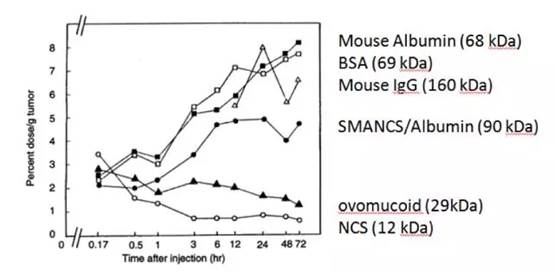
大分子化合物对肿瘤组织的高渗漏和潴留特性
这也同时阐明了绝大多数抗癌药物的药效低副作用大的原因:绝大多数抗癌药物,其分子量只有区区2kDa以下。它们在患者身体里以自由扩散原则分布到身体中的各个部分去,“自由扩散”使得在肿瘤组织中的药物浓度极低,也就意味着抗癌效果低;“到处都去”导致副作用大。1986年,前田与松村把这个现象称之为enhanced permeability and retention effect(简称EPR effect),他们将研究论文发到美国的《癌症研究》(Cancer Research)杂志后,两位论文评议员中一位评论说:这个是令人振奋的发现,马上付印!(Fantastic findings! Send to the press immediately!)。
我在前田实验室的研究课题,就是进一步阐明EPR effect的机制。我们用不同分子量大小的HPMA多聚物,再次证明了EPR effect。同时,我们也证明了除缓激肽之外,一氧化氮(nitric oxide)、前列腺素类(prostaglandins)、胶原蛋白酶/金属蛋白酶(collagenases/MMPs)都是促进/维持EPR效应的病理因子。
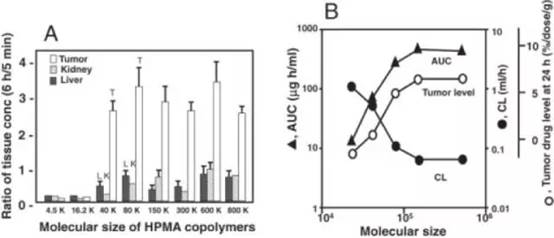
分子量在4万道尔顿以上的 HPMA 多聚物才表现出 EPR 效应
EPR effect理论很快得到世界著名科学家的认同和支持,其中有英国伦敦大学的著名科学家Ruth Duncan教授、德国Mainz大学的Helmut Ringsdorf教授、美国Virginia Commonwealth 大学William Regelson教授、美国哈佛大学医学院的Juldah Folkman教授等一大批世界著名学者。
从2002年开始,关于EPR effect概念的引用率开始增加,到2006年以后出现井喷现象,全世界几乎所有用纳米材料、多聚物、抗体、脂质体等大分子作为抗癌药物研发的学者,都在引用EPR effect作为他们的设计理论基础。汤森路透这次之所以推测前田和松村获得诺贝尔化学奖,就是因为EPR effect的高引用率。汤森路透社因此授予前田教授2016年度最具影响力和论文引用奖(Thomson Reuter Award for most influential and cited paper for 2016)。
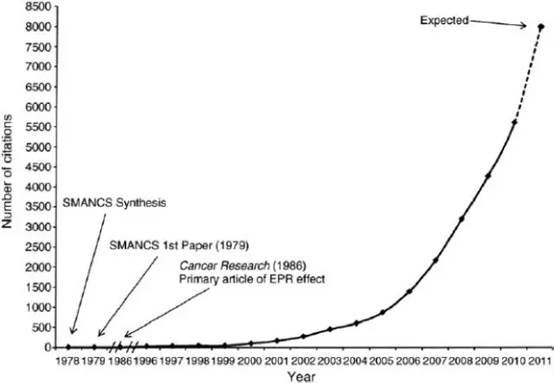
EPR 效应的引用率令人瞩目
1997年,日本最著名的癌症学术荣誉奖——高松宫妃癌研究基金学术奖,颁发给了前田教授,以表彰他的SMANCS研发和EPR effect理论的卓越成就。2003年,美国控制释放学会(Controlled Release Society)/东京永井纪念药学基金会(Nagai Foundation)授予前田CRS Nagai Innovation Award。2007年,英国皇家药学会授予前田终身成就奖(Life Time Achievement Award)。2010年,前田获得著名的第70届西日本文化功劳奖。2011年,前田获得日本药物递呈学会最高奖--Nagai奖,同年获得日本癌症学会的最著名的Tomizo Yoshida奖。
阐明细菌蛋白酶致病机制
前田教授是一个研究兴趣广泛的科学家,实际上他在细菌蛋白酶的病原机制研究上也有很大的建树。他和他的研究生阐明细菌的蛋白酶是引起炎症破坏的主要元凶之一,抑制细菌蛋白酶的破坏作用是治疗恶性细菌感染(例如眼角膜感染)的重要方法。细菌蛋白酶还可以促进病毒(例如流感病毒)的增殖、入侵和引发病变。细菌蛋白酶通过激活激肽(Kinin)连锁反应导致炎症和血管渗透性改变,是其中重要的病理机制之一。因对细菌蛋白酶和激肽的研究成就,他在1995年获得日本细菌学会颁发的最高奖Asakawa奖、1998年获得德国E.K. Frey-E.Werle基金会颁发的Commemorative Gold Medal Award。
阐明流感病毒感染过程中的超氧自由基病理损伤机制



