研究揭示LARP7介导U6修饰及其在生精细胞mRNA精准剪接和精子发生中的功能
2020-02-04 分子细胞科学卓越创新中心/生物化学与细胞生物学研究所
【字体:大 中 小】

语音播报

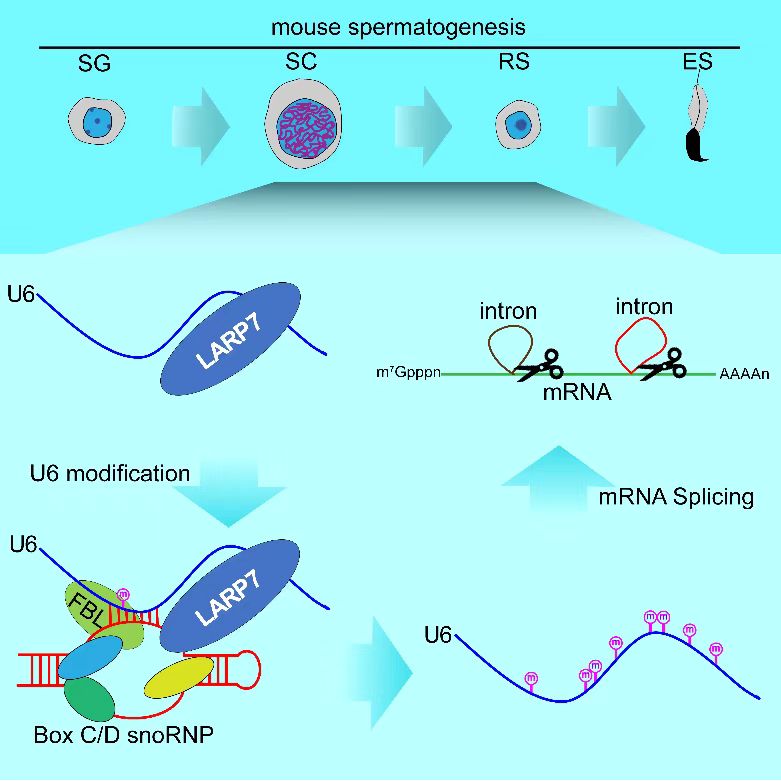
2月3日,国际学术期刊Molecular Cell 在线发表了中国科学院分子细胞科学卓越创新中心/生物化学与细胞生物学研究所刘默芳研究组的最新研究成果“LARP7-Mediated U6 snRNA Modification Ensures Splicing Fidelity and Spermatogenesis in Mice”。该研究报道了LARP7蛋白通过促进U6 snRNA与具有RNA甲基化催化活性的box C/D snoRNP相互作用,介导了U6的2′-O-甲基化修饰,并进一步证明此过程为小鼠生精细胞中mRNA剪接保真性及精子发生必需。 在真核细胞中,绝大部分新转录mRNA转录本(Pre-mRNA)需经过剪接移除内含子,才能形成可翻译的成熟mRNA,此过程由包括五种snRNA(U1、U2、U4、U5、U6)及其相互作用蛋白组成的剪接体(spliceosome)催化完成。在5种剪接体snRNA中,U6的保守性最强,位于剪接体催化中心且为剪接体催化活性必需。U6存在多种修饰,其中2′-O-甲基化修饰最为丰富,多个U6修饰从酵母到人完全保守。然而,目前对这些修饰的调控机制及其与mRNA剪接之间的关系尚知之甚少。此外,哺乳动物的精子发生是一个复杂而精细的细胞分化过程,受到特定基因时空特异性的调控。与之一致的是,在哺乳动物成年个体中,相较于其他组织,睾丸组织的转录活性和可变间接频率都是最高的,但生精细胞中转录出来的大量mRNA是如何被快速而精确地剪接,领域中却鲜有报道。 刘默芳研究组与国内外多家实验室合作,以小鼠睾丸为研究系统,探索了U6 snRNA修饰的调控机制及其在mRNA剪接中的功能,发现一个在睾丸高表达的RNA结合蛋白LARP7,对生精细胞中U6的2′-O-甲基化修饰至关重要。已有研究发现,LARP7通过与7SK RNA结合,抑制RNA聚合酶II转录延伸,还有研究发现Larp7基因突变与人类Alazami综合征相关。进一步的机制研究揭示,LARP7同时结合U6和snoRNA,协助U6装载到box C/D snoRNP上,进而促使box C/D snoRNP中的甲基转移酶FBL对其进行2′-O-甲基化修饰。更重要的是,LARP7介导的U6 2′-O-甲基化修饰对小鼠生精细胞中的mRNA精确及精子发生至关重要,生殖细胞条件性敲除Larp7基因致小鼠雄性不育。此项研究揭示了U6 snRNA修饰的调控机制,并首次证明U6 2′-O-甲基化修饰对哺乳动物mRNA的精准剪接及精子发生至关重要。 该项研究工作在刘默芳指导下,由分子细胞卓越中心博士后王鑫、博士研究生李智彤、闫越和中山大学博士研究生林鹏辉共同完成。同时,该研究得到德国维尔茨堡大学教授Utz Fischer,雷根斯堡大学教授Gunter Meister,分子细胞卓越中心研究员李党生、李劲松、惠静毅,复旦大学教授林金钟和中山大学教授杨建华等的大力协助。该项成果受到国家自然科学基金委、科技部、中科院、上海市科委等的经费支持。该工作的数据收集还得到分子细胞卓越中心公共技术服务中心动物实验技术平台、分子生物学技术平台和细胞分析技术平台和国家蛋白质科学中心(上海)等的支持。