2018年7月31日/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的8月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nature:重大突破!肌醇六磷酸是HIV-1组装和成熟所必需的
doi:10.1038/s41586-018-0396-4
在一项新的研究中,来自美国康奈尔大学、弗吉尼亚大学、特拉华大学、密苏里大学、德国欧洲分子生物学实验室和奥地利科技学院的研究人员提供了HIV-1病毒结构是如何组装的新细节,这一发现为治疗这种病毒感染提供了潜在的新靶标。相关研究结果于2018年8月1日在线发表在Nature期刊上,论文标题为“Inositol phosphates are assembly co-factors for HIV-1”。
在HIV-1的未成熟发育和成熟发育阶段,IP6在形成蛋白晶格结构的通路中起着关键作用。当这种病毒在细胞内发育时,它有助于组装未成熟的晶格。这种未成熟的晶格在这种病毒出芽后会遭受降解,并从细胞膜上切割下来。在此期间,IP6还促进一种成熟的蛋白晶格在这种病毒颗粒内组装。
2.Nat Commun:HIV RNA表达抑制剂可能恢复HIV感染者的免疫功能
doi:10.1038/s41467-018-05899-7
在大多数接受治疗的HIV感染者中,免疫激活和炎症持续存在,并且与过高的死亡率和发病率风险相关联。在一项新的研究中,来自美国波士顿大学医学院的研究人员发现利用HIV RNA表达抑制剂作为辅助治疗可能会减少非典型炎症,并且在接受联合抗逆转录病毒疗法(cART)治疗的HIV感染者中恢复免疫功能。相关研究结果于2018年8月27日在线发表在Nature Communications期刊上,论文标题为“HIV-1 intron-containing RNA expression induces innate immune activation and T cell dysfunction”。论文通信作者为波士顿大学医学院的Rahm Gummuluru和Hisashi Akiyama。
HIV-1感染者有过高风险出现非艾滋病并发症(non-AIDS complication),如心血管动脉粥样硬化、神经认知功能障碍、非艾滋病癌症(non-AIDS cancer)、骨质疏松症和肾脏疾病。人们已提出全身性慢性免疫激活导致这些非AIDS并发症。
尽管cART能够实现长期的病毒抑制,但是人们仍不清楚慢性炎症在HIV感染者中是如何形成的。在这项研究中,这些研究人员鉴定出HIV-1诱导的慢性免疫激活和T细胞功能障碍的机制。在对原代人巨噬细胞和T细胞进行的研究中,他们发现即使在没有感染性病毒产生的情况下,HIV-1持续感染巨噬细胞,而且含有内含子的HIV-1 RNA的表达就足以诱导共培养的T细胞产生I型干扰素依赖性促炎反应和遭受免疫衰竭。他们认为这些发现可能为在接受cART治疗的HIV感染者中观察到的慢性炎症相关疾病提供了解释。
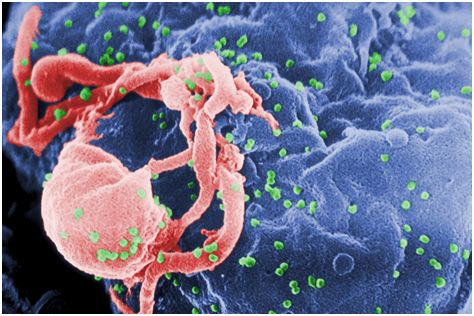
3.PLoS Biol:新研究揭示HIV感染者为何会患上神经系统疾病
doi:10.1371/journal.pbio.2005315
在一项新的研究中,来自美国科罗拉多州立大学的研究人员利用猫免疫缺陷病毒(feline immunodeficiency virus, FIV)研究了这个问题。FIV感染猫,与HIV是非常类似的。这项研究表明FIV和HIV都具有一种改变神经元活动的核心细胞通路,并鉴定出一种在HIV相关的神经系统疾病中发生的特定分子通路。相关研究结果近期发表在PLoS Biology期刊上,论文标题为“HIV induces synaptic hyperexcitation via cGMP-dependent protein kinase II activation in the FIV infection model”。论文通信作者为科罗拉多州立大学的Seonil Kim。论文第一作者为科罗拉多州立大学兽医医学博士项目二年级学生Keira Sztukowski。
图片来自PLoS Biology, doi:10.1371/journal.pbio.2005315。
4.NEJM:重大进展!人体临床试验表明伊巴利珠单抗可用于治疗多重耐药性HIV感染
doi:10.1056/NEJMoa1711460; doi:10.1056/NEJMp1808729
在一项新的研究中,来自美国耶鲁大学医学院和凯泽基金会研究所等研究机构的研究人员报道在晚期的耐药性HIV感染的患者中,一种新的HIV药物可减少HIV病毒复制和增加免疫细胞的水平。当与现存的HIV药物联合使用时,这种新的药物对已用完有效治疗方案的患者而言是一种很有前景的策略。相关研究结果发表在2018年8月16日的New England Journal of Medicine期刊上,论文标题为“Phase 3 Study of Ibalizumab for Multidrug-Resistant HIV-1”。论文通信作者为TaiMed Biologics公司的Stanley Lewis博士,论文第一作者为耶鲁大学医学院的Brinda Emu博士。
对一些HIV感染者而言,现有的药物疗法无法抑制这种病毒,这导致耐药性出现和疾病恶化。尽管有几种HIV药物有效地靶向这种病毒,但是十年来还没有一种新的HIV药物被批准用于治疗这种疾病。2018年3月,FDA批准了伊巴利珠单抗(ibalizumab),它靶向HIV入侵CD4 T细胞(一种免疫细胞)所需的一种主要受体。这种新的作用机制能够阻止HIV入侵靶细胞。
包括耶鲁大学在内的多个机构参与了这项研究,招募了40名遭受多重耐药性HIV感染的患者。除了失败的治疗方案外,这些患者在一周内通过静脉注射接受一剂伊巴利珠单抗治疗。在此之后,他们接受了伊巴利珠单抗与优化治疗方案组合治疗六个月。
这些研究人员发现,在接受伊巴利珠单抗治疗一周后,在参加这项研究的40名患者中,绝大多数患者(占83%)中的HIV病毒载量(即血液中检测到的HIV数量)下降了。在25周后,将近一半患者的病毒载量下降到检测水平之下。他们还报道这些患者的CD4 T细胞水平增加了。他们说,一名患者经历了一次不良事件,这种不良事件被认为与伊巴利珠单抗治疗相关,也因此导致这名患者退出这项研究。
Emu说,这些研究结果对这些耐药性HIV感染者人群而言是非常显著的:“这些患者处于晚期的耐药性HIV感染阶段,具有有限的治疗方案。在6个月内,观察到这些患者中的大多数人体内的HIV病毒受到抑制是令人振奋的。对遭受高度耐药性HIV感染的患者来说,这些结果代表着一种急需的新作用机制。”
5.Nat Immunol:在HIV感染期间,IgG3抗体阻止B细胞抵抗病原体
doi:10.1038/s41590-018-0180-5
在一项新的研究中,来自美国国家卫生研究院(NIH)所属的国家过敏症与传染病研究所(NIAID)的研究人员首次证实在某些HIV感染者中,一类被称为免疫球蛋白G3(IgG3)的抗体阻止免疫 系统中的B细胞发挥它们抵抗病原体的正常功能。根据这些研究人员的说法,这种现象似乎是身体试图减少因HIV的存在引起免疫系统过度活跃而带来的潜在破坏性影响的一种方式,但是这样做,它也会损害正常的免疫功能。相关研究结果于2018年8月13日在线发表在Nature Immunology期刊上,论文标题为“IgG3 regulates tissue-like memory B cells in HIV-infected individuals”。
这些研究人员通过分析来自83名未感染HIV的匿名捐赠者和108名处于不同感染阶段的HIV感染者的血液样本而取得他们的发现。这些HIV感染者具有各种种族和民族背景。其中的一些HIV感染者 正在接受治疗,而另一些HIV感染者尚未开始接受治疗。
这些研究人员观察到IgG3仅在某些条件下出现在B细胞的表面上。它出现在HIV感染者身上,但不会出现在非HIV感染者身上。此外,在未经治疗的HIV感染的慢性阶段(此时HIV病毒并未得到充 分控制),IgG3主要出现在非裔美国人或非洲黑人后裔的B细胞表面上。
在正常情形下,B细胞上的被称作B细胞受体(B cell receptor)的位点结合到诸如病原体之类的外源入侵者上。这种结合促进B细胞产生这种受体的抗体形式的多个拷贝,这会捕获病原体使 之随后遭受摧毁。这些研究人员发现在某些HIV感染者体内,IgG3通过停靠在B细胞受体上,让这个过程发生短路,从而阻止它对病原体或其他的预期靶标作出适当的反应。他们还展示了免疫 系统中的其他组分如何在HIV感染期间导致IgG3干扰正常的B细胞功能。最后,他们证实当慢性HIV感染者开始接受控制这种病毒的治疗时,IgG3停止结合到B细胞受体上,这就说明IgG3的活性 与慢性感染期间HIV的存在直接相关联。
6.JCR & JIAIDSS:神药又显神威!低剂量的阿司匹林或能有效抑制HIV感染和传播!
doi:10.1016/j.jconrel.2018.03.010; doi:10.1002/jia2.25150
近日,来自加拿大马尼托巴大学等机构的科学家们通过研究发现,低剂量的阿司匹林或有望抑制HIV的传播,相关研究刊登于国际杂志Journal of Controlled Release和Journal of the International AIDS Society上。
HIV的感染率在人群中依然很高,尤其是在年轻的非洲女性中,这项研究中,研究人员通过对一组来自肯尼亚HIV低风险的女性进行联合研究,检测了乙酰水杨酸(ASA或阿司匹林)和其它抗炎药物对HIV靶向细胞的作用效果。前期研究结果刊登于Journal of the International AIDS Society杂志上,该结果建立在炎症在HIV传播过程中所扮演角色的基础之上。
病毒的传播需要人类宿主机体中的易感靶向细胞,相比其它细胞而言,活性免疫细胞常常对HIV的感染非常易感,而且研究人员都知道,炎症常常会将激活的HIV靶向细胞带到女性生殖道中。这项研究得到了加拿大卫生研究院等机构的资助,研究者发现,阿司匹林能够作为一种有效的抗炎性药物,来降低女性生殖道中35%的HIV靶向细胞的数量,此外,研究结果还表明,服用阿司匹林的女性机体中HIV靶向细胞数量的减少的程度达到了感染高风险HIV但多年来一直未受感染的肯尼亚妇女机体的水平。
研究者表示,发表在the Journal of Controlled Release杂志上的研究报告的结果基于研究人员利用阴道环来降低哺乳动物模型机体炎症这一结论,后期研究人员还需要进行更为深入的研究来证实利用阿司匹林所得到的研究结果,他们希望能通过深入的研究来检测是否靶细胞水平的降低真的能够抑制HIV的感染和传播。Fowke博士说道,如果的确是这样的话,那么阿司匹林或许就能作为一种廉价便于进行的策略帮助人们有效预防HIV的感染,生活在贫困地区的人们或许就能利用这种方法来抵御感染HIV的风险了。
7.Immunity:新的抗体分析方法可加快合理的HIV疫苗开发
doi:10.1016/j.immuni.2018.07.009
在一项新的研究中,来自美国斯克里普斯研究所的研究人员提出了一种更快的方法来分析实验性疫苗抵抗HIV和其他病原体的结果。他们的新方法让科学家们快速地评估对一种病原体或疫苗作出反应时个体产生的全部抗体谱,并确定这些抗体是否可能有效地抵抗这种病原体。相关研究结果于2018年8月7日在线发表在Immunity期刊上,论文标题为“Electron-Microscopy-Based Epitope Mapping Defines Specificities of Polyclonal Antibodies Elicited during HIV-1 BG505 Envelope Trimer Immunization”。论文通信作者为斯克里普斯研究所的Lars Hangartner博士和Andrew Ward博士。
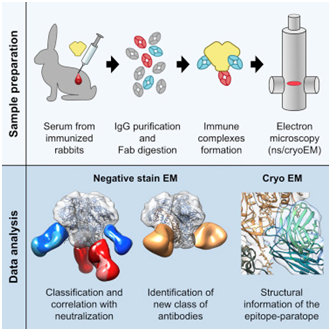
图片来自Immunity, doi:10.1016/j.immuni.2018.07.009。