在之前的科普文章中,我们见识到了安罗替尼是如何调控肿瘤血管基质重编程和肿瘤细胞重编程的,当然安罗替尼的能力不止于此,它还可以重塑肿瘤免疫微环境。
肿瘤免疫微环境是什么样子呢?
正如我们拥有地球这个美丽的家园,肿瘤细胞也有自己赖以生存的环境。肿瘤细胞发生发展之后,会将自己周遭的环境塑造成一座堡垒,“肿瘤堡垒”中有被肿瘤策反的“叛变士兵”(如Treg细胞、M2细胞、N2细胞)以及叛变士兵后勤人员(如VEGF、TGF-β1、IL-10等细胞因子)做辅助,堡垒外阻隔着可以将肿瘤消灭的“正义士兵”(如NK细胞、CD8+T细胞、CD4+T细胞)和正义士兵辅助人员(如TNF-α、IL-2、IFNγ等细胞因子)[1]。其中“叛变士兵”善于阻击,阻止“正义士兵”近距离接触肿瘤细胞,或者削弱“正义士兵”的战斗力,弱化对肿瘤的杀伤作用,
安罗替尼作为一种抗血管靶向药物,可以重塑肿瘤免疫微环境,破坏“肿瘤堡垒”的城墙,减少内部的“叛变士兵”,削弱堡垒内后勤力量;同时攻破城堡让“正义士兵”顺利进入城堡,还能增强正义士兵辅助人员的战斗力。和PD-1/PD-L1强强联合时,更能快速揭开肿瘤的伪装,发挥更强大的杀伤作用。
·安罗替尼可以最大程度削弱“肿瘤堡垒”的核心兵力
肿瘤堡垒非常牢固,外部的“正义士兵”如NK细胞、CD8+T细胞、CD4+T细胞尽管有心杀敌,但是奈何进入不了免疫屏障这座城堡,浑身武力发挥不了任何作用,只能在外边干着急。安罗替尼这位“大侠”的出现,可以帮助破坏免疫屏障这座“肿瘤堡垒”,让“正义士兵”顺利进入内部杀敌制胜。
安罗替尼可以减少帮助肿瘤生长的“叛变士兵”如Treg细胞、M2细胞、N2细胞等的数量,同时增加“正义士兵”如NK细胞、CD8+T细胞、CD4+T等细胞的数量。双重作用,以实现更大程度的破坏“肿瘤堡垒”的目的。
研究数据显示,在肾细胞癌动物模型中,安罗替尼单药或联合用药显著提高了CD8+T细胞、CD4+T细胞等有抗肿瘤作用的细胞含量,降低了Tregs细胞等有促肿瘤作用的细胞含量。
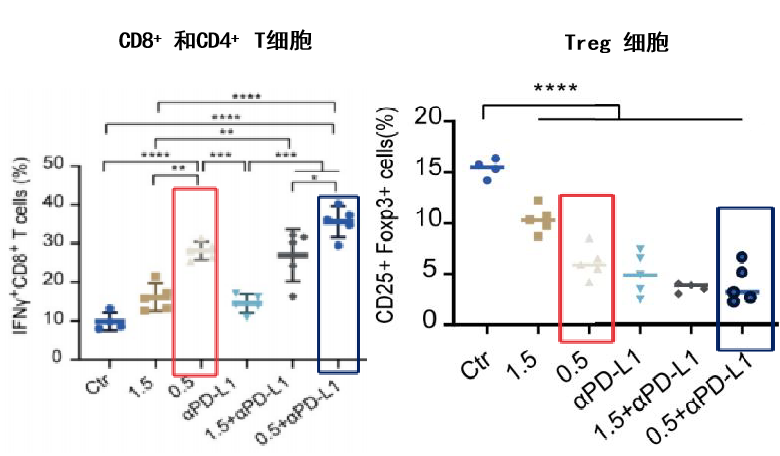
安罗替尼增加抗肿瘤细胞数量,减少促肿瘤细胞数量[2]
·安罗替尼可以削弱“肿瘤堡垒”的后勤力量,同时增强“正义士兵”的团队力量
后勤人员(如VEGF、TGF-β1、IL-10等细胞因子)给予了“肿瘤堡垒”非常重要的支持,他们的存在能使堡垒更坚固,使堡垒内的反派势力愈加强大。安罗替尼能在破坏堡垒的基础上削弱堡垒里后勤人员的力量,使“肿瘤堡垒”更加不堪一击;还能增强外部“正义士兵”辅助人员(如TNF-α、IL-2、IFNγ等细胞因子)的战斗力,赋予他们团队更强大的力量。
多个肺癌动物模型研究显示,安罗替尼单药或联合放疗、免疫治疗能够有效降低IL-10、IL-4的释放,同时增加抗肿瘤细胞因子TNF-α的释放。
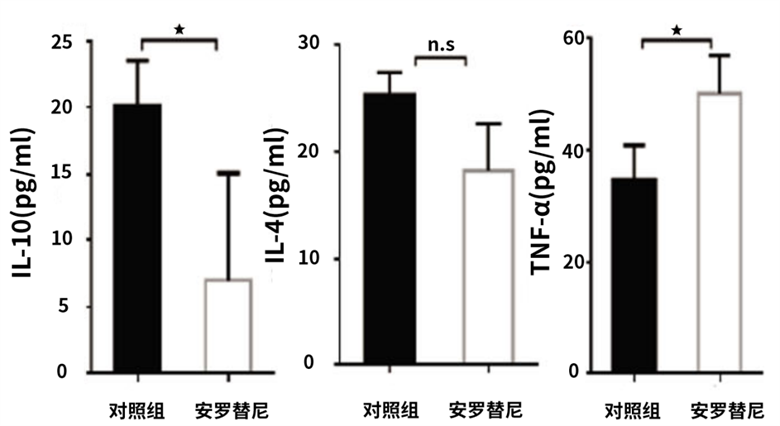
安罗替尼降低IL-10、IL-4等免疫抑制细胞因子释放,增加抗肿瘤细胞因子TNF-α的释放[3]
·安罗替尼和PD-1/PD-L1单抗联合可以发挥更大的威力
安罗替尼“大侠”不仅自己能力强大,还善于和其他的“高手”(比如PD-1/PD-L1单抗)强强联合,以更大程度上消灭肿瘤并清除肿瘤建造的坚实堡垒。PD-1/PD-L1单抗可以识破肿瘤的伪装,安罗替尼能够帮助PD-1/PD-L1单抗更多地到达肿瘤部位,帮助“正义士兵”进入肿瘤堡垒,发挥抗肿瘤作用。
小细胞肺癌、非小细胞肺癌、肝细胞癌等多种实体瘤的试验研究显示,安罗替尼联合PD-1/PD-L1单抗治疗取得了良好疗效,最长的中位无进展生存期可达到近23个月。
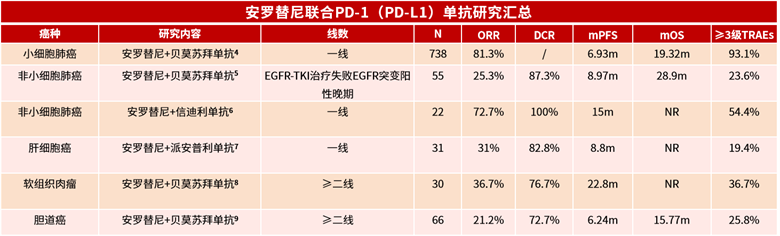
安罗替尼联合PD-1/PD-L1单抗的研究汇总
总结
肿瘤免疫微环境是一个复杂的组成,在肿瘤的发生发展过程中扮演着重要角色。安罗替尼可以重塑肿瘤免疫微环境,从多维度削弱肿瘤的力量,对肿瘤造成更毁灭性的杀伤作用;联合PD-1/PD-L1使用,更能起到联合增效的作用,对于肿瘤的临床治疗具有重要意义。
参考文献:
1. Altorki et al. Nat Rev Cancer. 2019; 19(1):9-31.
2. Su, et al. Clin Cancer Res. 2022 Feb 15;28(4):793-809.
3. Liu, et al. Cell Death and Disease (2020) 11:309.
4. Benmelstobart with Anlotinib plus Chemotherapy as First-line Therapy for ES-SCLC: A Randomized Double-blind Phaselll Trial (ETER701). 2023WCLC.
5. A phase I/ll study of TQB2450 (Benmelstobart), a PD-L1 mAb, plus anlotinib in EGFR+ advanced NSCLC patients failed to prior EGFRTKI therapies: Phase ll results update. 2023WCLC.
6. Chu T, et al. J Thorac Oncol. 2021; 16(4):643-652.
7. Han C, et al. Front Oncol. 2021; 11:684867.
8. Liu J, et al. Clin Cancer Res. 2022; clincanres.0871.2022-3-18 10:13:03.583.
9. Zhou J, et al. Hepatology. 2022.



